
こんにちは!薬剤師うさぎです
突然ですが、あなたは細菌の耐性機構は好きですか?
私は大学の微生物学の講義で細菌の耐性機構を知ったことで微生物の世界に魅入り、卒業研究では感染制御の研究室で日夜薬剤耐性菌・多剤耐性緑膿菌に関する研究をしていました。
その過程で耐性機構に関しては色々調べる機会が多くあったのですが、最近その当時のメモを見返すことがたまにあるため、今回はそんな耐性機構大好きな私が細菌(特に緑膿菌)の耐性機構について記事にまとめることにしました。
- 細菌の耐性機構に興味がある医療従事者・薬学生
- 細菌のことは興味ないし苦手だよっていう医療従事者・薬学生
などの方はぜひ読んでみてください。特に薬学生は耐性機構を知ることで細菌の魅力に取り入られ私のように人生が変わるかもしれません。変わらないかもしれません。
記事執筆にあたり、当時の情報に加えて最近の細菌の知見もできるだけ改めて調べるようにしていますが、もしかしたら情報が古くなっているかもしれません。性質的にはあまり古くなるものでもないとは思いますが、一応ご了承ください。
もくじ
細菌が抗菌薬耐性を獲得する手段
一般的に細菌が抗菌薬に対して耐性を獲得する手段としては次の2つがあります。
- 保有遺伝子の自然突然変異
- 外来遺伝子の獲得
(1)はその細菌が潜在的に持っていた耐性遺伝子が変異により働き出したり、あるいはある程度働いていた遺伝子が変異により発現亢進したり遺伝子産物が機能亢進したりする場合を指します。
(2)は他の細菌から耐性遺伝子を獲得する場合を指します。
細菌の間ではいくつかの方法により遺伝子の伝達が起こりますが、耐性遺伝子も例外ではなく細菌間で伝達が起こります。
細菌間での遺伝子の伝達は①形質転換、②接合、③形質導入などで行われます。
詳細な説明は今回は省略するので、詳しく知りたい方は調べてみてください。
緑膿菌の抗菌薬耐性機構
緑膿菌の主な耐性機構は主に次の4つに分類されると考えられます。
- 酵素による抗菌薬の不活化
- 抗菌薬作用点の変化による薬剤の親和性低下
- 抗菌薬の膜透過性の低下
- 抗菌薬の細胞外への能動的排出
これらを順番に解説していきますね。
酵素による抗菌薬の不活化

細菌の中には抗菌薬を分解する酵素や修飾する酵素を持ち、その抗菌活性を失わせるものがあります。
これは有名なので名前は聞いたことがあるかもしれません。
β-ラクタマーゼとは何ぞや?
一言でいうと、β-ラクタマーゼとはβ-ラクタム系抗菌薬の母核構造中のβ-ラクタム環を加水分解し抗菌活性を失わせる細菌酵素のことです。
β-ラクタマーゼは活性中心にセリン残基を持つセリン-β-ラクタマーゼと、亜鉛をco-factorとするメタロ-β-ラクタマーゼの2種類に大別されます。
セリン-β-ラクタマーゼは一次構造の類似性からAmber分類でクラスA, C, Dの3つに分類されており、β-ラクタム系抗菌薬においてペニシリン型のものをよく加水分解する酵素をペニシリナーゼ、セファロスポリン型のものをよく加水分解する酵素をセファロスポリナーゼと呼びます。クラスAとDはペニシリナーゼ型であり、クラスCはセファロスポリナーゼ型に分類されます。
AmpCという言葉も聞いたことがあるかもしれません。
染色体性のβ-ラクタマーゼであるAmpCはクラスCに属するβ-ラクタマーゼであり、腸内細菌科細菌のほとんどは染色体上にその遺伝子を持っています。
緑膿菌においても各種β-ラクタム系抗菌薬への自然耐性に寄与しており、臨床分離株においてもAmpC過剰産生株が多数報告されています。
こちらも最近よく聞くESBL。
クラスA、C、Dに属するβ-ラクタマーゼの多くはプラスミドやトランスポゾン上に存在します。近年、クラスAのβ-ラクタマーゼでは本来加水分解できない第2世代セフェムや第3世代セフェムを分解できるようになった変異型のクラスAのβ-ラクタマーゼを産生する菌が現れ、それらの酵素は基質拡張型β-ラクタマーゼ(Extended-Spectrum β-Lactamase:EBSL)と呼ばれ、臨床上問題となっています。
 【3分でわかる】ESBL産生菌とは?使用される抗菌薬まとめ
【3分でわかる】ESBL産生菌とは?使用される抗菌薬まとめ
ESBL産生菌に使う抗菌薬については別記事でまとめているので興味があればこちらも併せてどうぞ!
メタロ-β-ラクタマーゼはクラスBに分類されモノバクタム以外のほとんど全てのβ-ラクタム系抗菌薬を分解する酵素です。
活性中心に亜鉛を持つことからメタロ-β-ラクタマーゼと呼ばれています。また、他のβ-ラクタマーゼと違いカルバペネム分解能を持つことからカルバペネマーゼとも呼ばれます。
ほとんどのβ-ラクタム系抗菌薬を分解することができるうえにβ-ラクタマーゼ阻害薬による阻害効果を受けないので、カルバペネマーゼ産生菌はほぼ全てのβ-ラクタム系抗菌薬に耐性を示すのが一般的です。
このメタロ-β-ラクタマーゼ遺伝子の菌種間での移動は臨床上重大な問題となっています。
アミノグリコシドの官能基に修飾して不活化する酵素があります。
それらの酵素により修飾された薬剤は、標的であるリボソームへの結合親和力が低下してしまいます。
アミノ配糖体修飾酵素によるアミノグリコシド系抗菌薬の不活化の修飾様式にはリン酸化、アデニリル化、アセチル化の3タイプがあり、それぞれAPH(リン酸化酵素)、AAD/ANT(アデニル化酵素)、AAC(アセチル化酵素)により修飾反応が行われます。
抗菌薬作用点の変化による薬剤の親和性低下
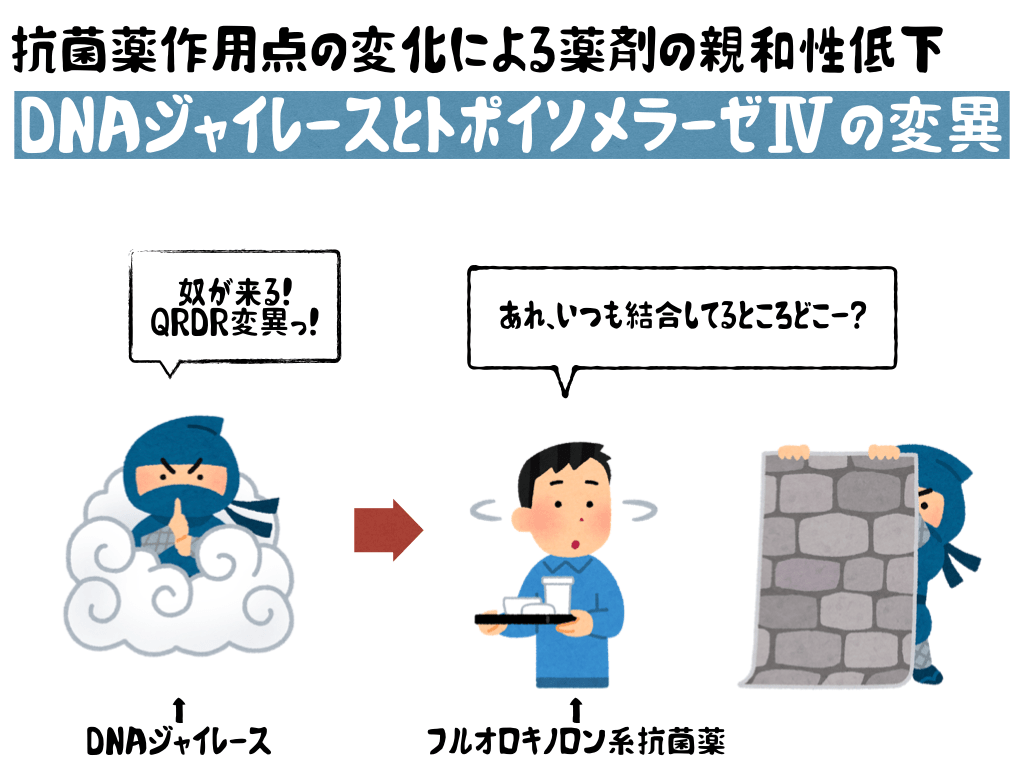
フルオロキノロン系抗菌薬は細菌のDNA複製に関与するDNAジャイレース(グラム陰性菌のprimary target)とトポイソメラーゼⅣ(グラム陽性菌のprimary target)と複合体を形成することにより、DNA合成を阻害し抗菌活性を示します。
それぞれの酵素は2つのAサブユニットとBサブユニットから構成されていて、DNAジャイレースはGyrAとGyrBサブユニット、トポイソメラーゼⅣはParCとParEサブユニットからなります。
フルオロキノロン耐性株ではDNAジャイレースのAサブユニットにあるキノロン耐性決定領域(QRDR)に変異が生じやすいとされます(Hooper DC., 2001)。そのためフルオロキノロン系抗菌薬がジャイレースに結合しにくくなり耐性となる例が多くの細菌で知られています。
緑膿菌におけるフルオロキノロン耐性臨床分離株ではgyrAに変異が入った株が最も一般的であり、さらにparCに変異が入ることでより高度耐性となった株の分離頻度も高いとされています(Akasaka T., 2001、Lee JK., 2005)。
抗菌薬の中にはタンパク合成の場であるリボソームを阻害するものが多いです。
アミノグリコシド系抗菌薬は細菌の30Sリボソームサブユニットに結合することによりmRNAのミスリーディングや翻訳の阻害を引き起こし、正常なタンパク合成を阻害します(Moazed D., 1987)。
RmtA遺伝子は16S rRNA methylaseをコードする遺伝子であり、細菌の30Sリボソームサブユニットの16S rRNAをメチル化することにより、アミノグリコシドの結合を阻害します(Yokoyama K., 2003)。
修飾酵素とは異なり、RmtAを緑膿菌が獲得すると広範囲のアミノグリコシドに対する高度耐性化が起こってしまいます。
抗菌薬の膜透過性の低下
多くの抗菌薬の作用点は細胞の内側にあります。抗菌薬が効力を発揮するには細胞の内側に到達しなければなりません。
すなわち、細菌細胞外に与えられた抗菌薬は外膜(グラム陰性菌の場合)や細胞質膜を通り抜けなければならないということを意味します。
グラム陰性菌の外膜は、細菌にとって有害な物質から身を守るための障壁としての機能も持っています。
マクロライド系、β-ラクタム系、リファンピシンなどの抗菌薬は一般にグラム陽性菌には低濃度で効果がありますが、グラム陰性菌にはかなり高い濃度でないと効果が見られません。
これは陰性菌の外膜が透過障壁となり、これらの抗菌薬が入りにくくなっているからです。
またバンコマイシンはグラム陰性菌には無効ですが、これもバンコマイシンが陰性菌の外膜を透過できないからとされています。
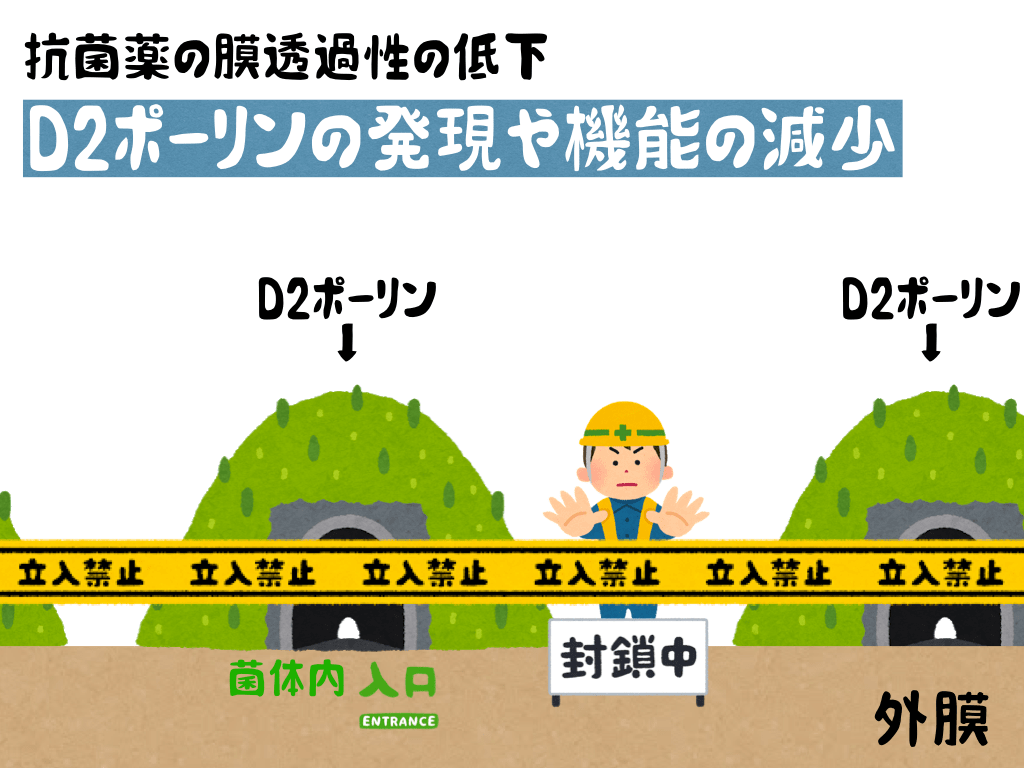
緑膿菌にはチャネルタンパク質であり外膜のリン脂質二重層に埋め込まれた形で存在し、膜を貫通する親水性の小孔であるポーリンがあります。
一部の抗菌薬はこのポーリンを通過して細胞内の作用点に到達します。
特にカルバペネム系抗菌薬はOprDタンパク質で構成されるD2 porinと呼ばれる透過孔を介して細胞内へ透過します。
この本来の機能は塩基性アミノ酸やこれらを含むペプチドを菌体内に取り込むための孔ですが、塩基性側鎖をもつカルバペネム系抗菌薬もペリプラズムにたどり着く過程でD2 porinを介して細胞内に透過します(Trias J., 1990)。
そこで、緑膿菌はOprDの減少あるいは変異により薬剤を体内に侵入しにくくすることで耐性を獲得しています。
ちなみにOprDは緑膿菌の生存にとっては必須ではないとされているので、減少しても菌自体の生育には問題があまり生じないのだと思います。
このOprDの減少による膜透過性の低下は、in vitroで分離したカルバペネム耐性変異株および臨床分離されたカルバペネム耐性変異株に共通するもっとも主要な耐性系であることが知られています(Kohler T., 1999)。
メロペネムやドリペネムはOprDを介した取り込みはあまり関与しないとされるためこの耐性機序の影響は受けにくいようですが、イミペネムやビアペネムは逆にOprDの影響を大きく受けるけれど排出ポンプ(後述)の影響は低いとされているようです。
OprDの減少はカルバペネム系抗菌薬の耐性にのみ影響し、その他のβ-ラクタム系抗菌薬やアミノ配糖体、フルオロキノロン等の耐性には影響を与えないとされています(Huang H et al., 1993、Kohler T et al., 1999)。
臨床分離株においてもOprDが減少した株が多く報告されていて、その中の多くの株においてoprD遺伝子の構造遺伝子中に生じた一塩基置換によるstop codonの形成、一塩基挿入や欠損によるフレームシフト変異が確認されています(Gutierrez O., 2007、Henrichfreise B., 2006、Quale J., 2006)。
抗菌薬の細胞外への能動的排出

細菌の中には、細胞内に入ってきた抗菌物質を能動的に細胞外に排出するポンプを持っているものがあります。
排出ポンプには、基質特異性の高い排出ポンプと基質特異性の低い排出ポンプがあり、基質特異性の高い排出ポンプは特定の抗菌薬を排出するので排出する基質によりテトラサイクリン排出ポンプ、マクロライド排出ポンプなどと呼ばれています。
一方、基質性の低い排出ポンプは多くの抗菌物質を細胞外に排出するので多剤排出ポンプ(multidrug efflux pump)と呼ばれています。
多剤排出ポンプは近年多くの細菌で見出されているもので、一旦菌体内に取り込まれた抗菌薬を菌体外へ排出する能動輸送体のことであり、これにより菌体内の薬剤濃度を低下させ菌体に耐性を付与するもののことを言います。
排出ポンプは一次構造の類似性や輸送に必要なエネルギー源の違いにより、RND family、MFS family、SMR family、MATE family、ABC familyの5つに分類されています(Putman M., 2000)
そのうち、緑膿菌の多剤耐性に最も深くかかわっているものはRND familyに属する多剤排出ポンプであり、RND familyの中でもMexAB-OprM、MexXY-OprM、MexCD-OprJ、MexEF-OprNなどは多くの抗菌薬を基質とする強力な多剤排出ポンプです(Poole K., 1996、Li XZ., 1995、Morita Y., 2001)。
特に、MexAB-OprMは緑膿菌野生株において構成的に発現しており、緑膿菌の抗菌薬自然耐性に大きく関与しています(Li XZ., 1995)。
緑膿菌感染症に用いられる抗菌薬のうち、アミノグリコシドを排出するのはMexXY-OprMであり、フルオロキノロンは上記4つの排出ポンプ全ての基質となります。これら4つの多剤排出ポンプの基質とその制御因子をTable 1に示しているので参照してください(Askoura M et al., 2011)。
Table 1. 緑膿菌における主要な排出ポンプの基質とレギュレーター
| 排出ポンプ | 基質 | Regulator |
| MexAB-OprM | β-ラクタム、フルオロキノロン、テトラサイクリン、クロラムフェニコール、マクロライド、トリメトプリム | MexR (リプレッサー) |
| MexCD-OprJ | βラクタム、フルオロキノロン、テトラサイクリン、クロラムフェニコール、マクロライド、トリメトプリム | NfxB(リプレッサー) |
| MexEF-OprN | フルオロキノロン、クロラムフェニコール、トリメトプリム | MexS(リプレッサー) MexT(アクチベーター) |
| MexXY-OprM | テトラサイクリン、エリスロマイシン、アミノグリコシド、フルオロキノロン | MexZ(リプレッサー) |
まとめ
緑膿菌の耐性機構には主に次の4つがあることを説明しました。
- 酵素による抗菌薬の不活化
- 抗菌薬作用点の変化による薬剤の親和性低下
- 抗菌薬の膜透過性の低下
- 抗菌薬の細胞外への能動的排出
また、大まかに抗菌薬毎に耐性機構を分類すると下記のようになります
- β-ラクタム系
- βラクタマーゼ
- D2ポーリンの発現や機能の減少
- キノロン系
- DNAジャイレースとトポイソメラーゼⅣの変異
- 薬剤排出ポンプ
- アミノグリコシド系
- 修飾酵素
- 16SRNAメチラーゼの産生
- 薬剤排出ポンプ
どうでしたか?細菌の耐性機構ってすごく興味深いですよね。
今回はグラム陰性菌である緑膿菌の耐性機構に着目しましたが、PBPの変異などグラム陽性菌ではまた別の耐性機構があったりもします。
また、バイオフィルムの産生など今回紹介しなかった耐性機構もあります。
たいへん奥深いので興味のある方は自分で色々調べてみるのも面白いと思います。
また需要があれば微生物、耐性菌に関する記事を書いていきたいと思うので、ご意見・ご感想・ご指摘・ご指導・ご鞭撻などあればぜひコメント欄までお願いします。
参考文献
土屋友房編(2018)「微生物学・感染症学」化学同人
横田伸一ほか, 多剤耐性緑膿菌(MDRP)の耐性機構, ICUとCCU 34(11): 973-979, 2010.
Akasaka T, Tanaka M, Yamaguchi A, Sato K. (2001), Type Ⅱ topoisomerase mutations in fluoroquinolone-resistant clinical strains of Pseudomonas aeruginosa isolated in 1998 and 1999: role of target enzyme in mechanism of fluoroquinolone resistance. Antimicrob Agents Chemother. 45(8): 2263-8
Askoura M, Mottawea W, Abujamel T, Taher I. (2011), Efflux pump inhibitors (EPIs) as new antimicrobial agents against Pseudomonas aeruginosa. Libyan J 6. doi: 10.3402/ljm.v6i0.5870.
Gutierrez O, Juan C, Cercenado E, Navarro F, Bouza E, Coll P, Perez JL, Oliver A. (2007), Molecular epidemiology and mechanisms of carbapenem resistance in Pseudomonas aeruginosa isolates from Spanish hospitals. Antimicrob Agents Chemother. 51(12):4329-35
Henrichfreise B, Wiegand I, Pfister W, Wiedemann B. (2007), Resistance Mechanisms of Multiresistant Pseudomonas aeruginosa Strains from Germany and Correlation with Hypermutation. Antimicrob. Agents Chemother. 51 : 4062-4070
Huang H, Hancock RE. (1993), Genetic definition of the substrate selectivity of outer membrane porin protein OprD of Pseudomonas aeruginosa. J. Bacteriol. 175: 7793-7800
Köhler T, Mehri Michea-Hamzehpour, Simone F. Epp, Jean-Claude Pechere (1999), Carbapenem activities against Pseudomonas aeruginosa: respective contributions of OprD and efflux systems. Antimicrob. Agents Chemother 43: 424-427
Lee JK, Lee YS, Park YK, Kim BS. (2005), Alterations in the GyrA and GyrB subunits of topoisomerase Ⅱ and the ParC and ParE subunits of topoisomerase Ⅳ in ciprofloxacin-resistant clinical isolates of Pseudomonas aeruginosa. Int J Antimicrob Agent. 25(4):290-5
Li XZ , Nikaido H, Poole K (1995), Role of mexA-mexB-oprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrob Agents Chemother. 39(9):1948-53
Moazed D, Noller HF. (1987), Interaction of antibiotics with functional sites in 16S ribosomal RNA. Nature. 327(6121): 389-94
Poole K (2005), Aminoglycoside Resistance in Pseudomonas aeruginosa Antimicrob. Agents Chemother. 49: 479-487
Putman M, van Veen HW, Konings WN. (2000), Molecular properties of bacterial multidrug transporters. Microbiol Mol Biol Rev. 64(4):672-93
Quale J, Bratu S, Gupta J, Landman D. (2006), Interplay of Efflux System, ampC, and oprD Expression in Carbapenem Resistance of Pseudomonas aeruginosa Clinical Isolates. Antimicrob. Agents Chemother. 50 : 1633-1641
Trias J, and Nikaido H. (1990), Outer membrane protein D2 catalyzes facilitated diffusion of carbapenems and penems through the outer membrane of Pseudomonas aeruginosa. Antimicrob Agents Chemother. Jan 1990; 34(1): 52-57
Yokoyama K, Doi Y, Yamane K, Kurokawa H, Shibata N, Shibayama K, Yagi T, Kato H, Arakawa Y. (2003), Acquisition of 16S rRNA methylase gene in Pseudomonas aeruginosa. Lancet. 362(9399): 1888-93



